- 과학향기 Story
- 스토리
스토리
[과학향기 Story] 난자와 정자 결합의 또 다른 비밀, 알파폴드가 풀다
<KISTI의 과학향기> 제3111호 2024년 11월 18일올해 노벨 화학상의 영예는 21세기 단백질 연구의 새로운 장을 연 연구자 3인에게 돌아갔다. 약 20년 전 미국 워싱턴대 데이비드 베이커 교수가 세상에 없던 새로운 단백질을 만드는 놀라운 시도를 감행했다면, 데미스 허사비스 딥마인드 CEO와 존 점퍼 딥마인드 수석연구원은 이 길을 따라 새로운 단백질 구조를 예측하는 인공지능 ‘알파폴드’를 개발했다. 수상을 주관하는 스웨덴 왕립과학원은 “놀라운 단백질을 만드는 것”과 “아미노산 서열로부터 단백질 구조를 예측하는 50년 묵은 꿈을 이룬 것”을 올해의 발견으로 꼽으며 이들의 공로를 치하했다.

이러한 가운데 최근 알파폴드로 난자와 정자의 결합이라는 오랜 난제의 결정적 단서를 찾은 연구가 발표되었다. 지난 10월 오스트리아 비엔나대학교 분자병리학연구소(IMP) 연구팀은 알파폴드를 이용해 난자-정자 결합에 핵심 역할을 하는 세 번째 단백질을 발견한 연구를 국제학술지 《셀》에 발표했다. IMP 연구진은 생식 세포의 수수께끼에 어떻게 접근했으며, 알파폴드는 어떤 역할을 했을까?
생명 현상에 다가가려면
인간 생명체의 출발인 생식 세포의 만남은 뭇 사람에게 강렬한 이미지로 기능하지만, 실상 두 세포가 만나는 순간 어떤 일이 일어나는지는 밝혀진 것이 많지 않다. 생명 탄생의 순간에 난자와 정자는 어떻게 서로 달라붙고 유전 물질을 공유하는가? 이러한 생명 활동은 그 고유한 특성으로 각 세포의 화학 반응을 일으키는 단백질로부터 비롯된다.
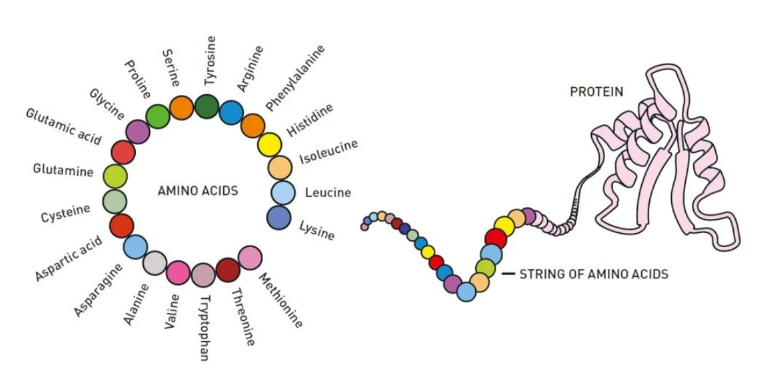
보통 크기의 단백질은 300개가량의 아미노산이 연결되어 만들어진다. 즉 단백질의 구조와 특징은 아미노산의 서열로 인해 결정되는데, 이렇게 아미노산끼리 서로 밀거나 당기며 형성된 고유의 3차원 구조를 ‘단백질 접힘’이라고 한다. 전통적인 단백질 접힘 연구는 엑스선 결정학, 핵자기공명 분광학, 저온 현미경 등을 활용해 왔다. 그러나 기존 방법은 시간이 오래 걸릴뿐더러 비용 부담이 상당했다. 즉 새로운 단백질 구조를 예측하는 연구는 기본적으로 많은 위험부담을 질 수밖에 없었다.
알파폴드라는 신기원
구글 딥마인드의 성과는 물리적 방법으로 고분자를 파고드는 대신 알고리즘을 통해 아미노산의 연결을 확률적으로 예측하는 길을 택한 데 있다. 알파폴드의 작동 방식은 다음과 같다. 미지의 아미노산 서열을 알파폴드에 입력하면 알파폴드는 데이터베이스에서 입력된 서열과 유사한 것을 찾는다. 이어 검색된 결과로부터 아미노산 상호작용을 진단하고, 단백질 접힘 구조를 파악할 수 있는 거리 지도를 생성한다.
딥마인드는 최초의 모델을 공개한 이래 그 예측 정확도를 차근차근 높여 나갔다. 2018년 12월 열린 단백질 구조 예측 대회(CASP)에서 처음 공개된 ‘알파폴드1’은 압도적인 점수 차를 벌리며 여러 모델 가운데 1위를 기록했다. 그로부터 2년 뒤 같은 대회에 참가한 ‘알파폴드2’는 그야말로 학계에 충격을 불러왔다. 예측 정확도가 거의 90퍼센트로, 과학자가 실제 실험을 통해 밝혀낸 것과 큰 차이를 보이지 않았기 때문이다.
2022년 7월, 딥마인드는 알파폴드2의 코드를 글로벌 오픈소스 플랫폼 ‘깃허브’에 공개했다. 모든 연구자가 자신의 연구 목적에 맞춰 예측 프로그램을 개량하거나 활용할 수 있게 된 것이다. 허사비스 대표 스스로 밝혔듯 ‘디지털 생물학’의 새 시대가 열린 셈이다.
수정의 순간에 관여하는 마지막 단백질, 알파폴드가 찾다
오스트리아 IMP 연구진의 발견으로 다시 돌아와 보자. 기존 연구에서 생식 세포의 결합에 관여하는 것으로 알려진 단백질은 2005년 일본 연구팀이 발견한 유전자 ‘이즈모(IZUMO)’, 2014년 영국 연구팀이 발견한 단백질 ‘주노(JUNO)’ 단 둘뿐이었다. 약 10년이 지나 IMP는 알파폴드를 활용해 새로운 수를 둔다. 연구진은 신기술로 ‘이즈모’와 ‘주노’에 이어 ‘Tmem81’이라는 세 단백질이 난자와 정자 사이의 중매 역할을 한다는 것을 예측했다. 이들이 이러한 단백질 복합제가 존재한다는 가설을 실제로 확인하는 식의 연구를 하게 된 것은 알파폴드의 높은 예측력 덕분이다.
척추동물의 생식 세포 상호작용에 관한 분자적 지식은 주로 쥐와 물고기의 유전 연구에서 왔다. IMP 연구진은 알파폴드를 사용한 단백질 간 상호작용 스크린을 통해 생쥐와 어류의 생식 과정에서 Tmem81을 필수적인 남성 생식 인자로 식별하여 다른 두 단백질 IZUMO1, SPACA6(정자 단백질)과 상호작용함을 발견했다. 그리고 포유류에서 이 삼중 단백질 복합체는 JUNO 유전자와 결합, 수정하는 난자 막과 정자를 연결한다.
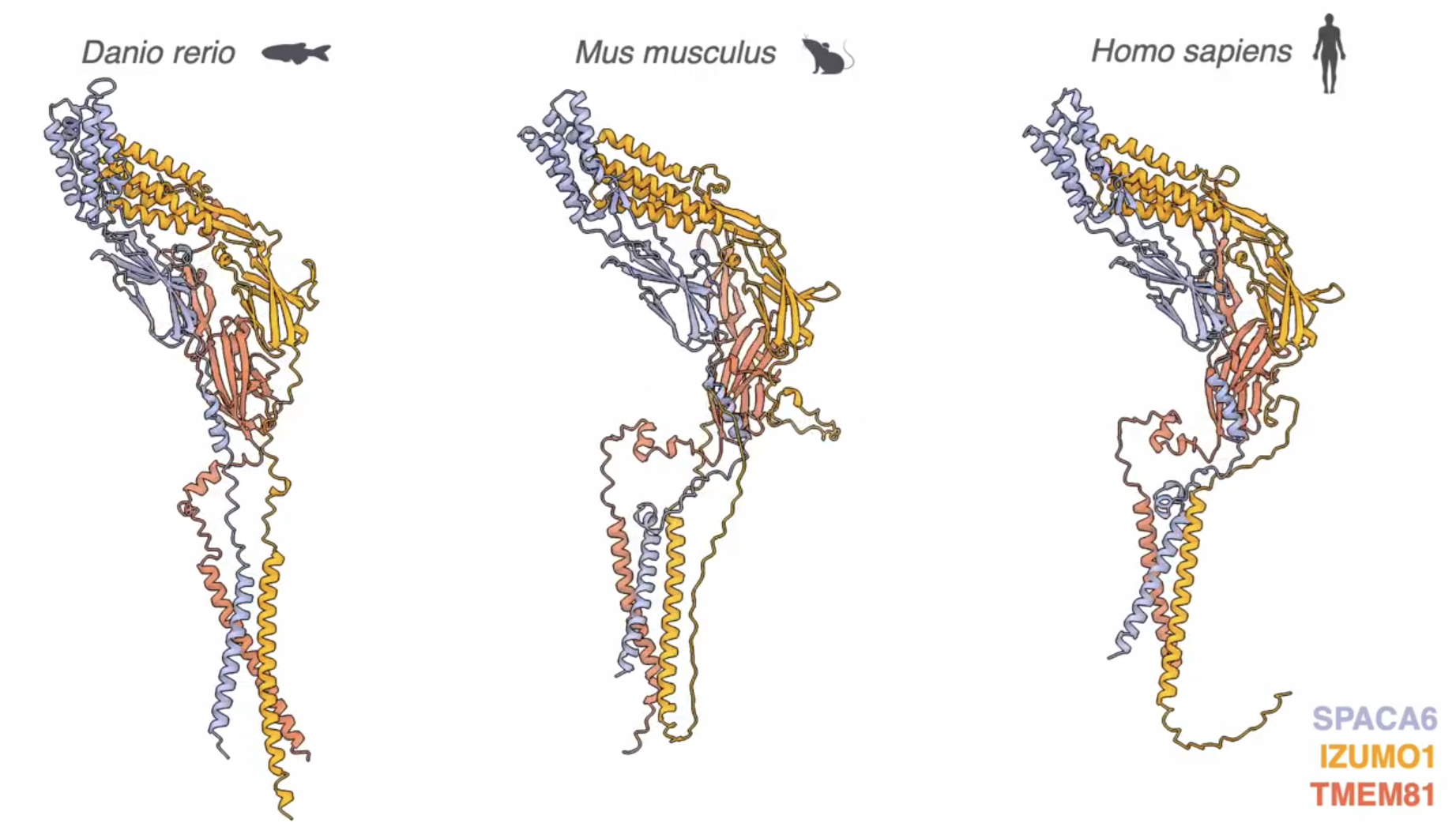
연구팀은 제브라피쉬와 생쥐에서 Tmem81를 제거했을 때 수컷 쥐와 물고기가 암컷과 달리 불임임을 확인했다. Tmem81을 제거한 수컷 물고기의 정자는 정상적인 운동성을 보였지만 난자에 안정적으로 부착되지 못했다. 수컷 쥐의 경우 정상적인 고환과 정상적인 형태 및 운동성의 정자를 가졌지만, 난자와 수정하지 못하거나 난포와 융합하지 못했다. 제브라피쉬의 정자에서 확인한 복합체가 인간에게서도 발견된바, IMP의 발견은 새로운 불임 치료법 또는 피임 방법을 찾는 데 도움이 될 것이다. 수정에 관여하는 단백질에 대한 지식이 늘수록 불임을 초래하는 돌연변이 메커니즘을 더 상세히 탐구할 수 있기 때문이다.
IMP의 연구는 생체 내, 그리고 실험실 환경에서 복합체 형성에 대한 직접적인 증거를 제공했다. 그러나 연구진은 이러한 복합체의 화학량론과 구조 등 세부 정보는 아직 탐색 중이며, 포유류 생체 내 환경에서 복합체가 형성된다는 증거는 되지 못한다고 덧붙였다. 수많은 새로운 단백질 연구가 한계와 함께 소개되고 있다. 그럼에도 알파폴드가 만들어 내는 수십만 장의 지도가 사실상 접근 불가능했던 생명 활동의 비밀을 푸는 첫걸음이 되리라는 점만은 분명해 보인다.

글 : 맹미선 과학칼럼니스트, 일러스트 : 유진성 작가

추천 콘텐츠
인기 스토리
-
- [과학향기 Story] 스페이스X 스타십, 집으로 돌아와 주차까지 완료!
- 파란 하늘 높은 곳에서 기다란 원통형의 물체가 떨어진다. 이내 끝부분에서 새빨간 불길이 뿜어져 나오지만, 물체는 속도를 줄일 뿐 여전히 아래로 내려온다. 그러고 몸체를 좌우로 기우뚱하며 방향을 바꾸는가 싶더니, 커다란 기둥에 다다른다. 이를 감지한 듯 기둥에 있는 집게 두 개가 오므라들며 원통형 물체를 잡아내고, 동시에 사람들이 환호성을 지릅니다. 로...
-
- [과학향기 Story] 식물인간 넷 중 하나는 당신 말을 듣고 있다
- 몇몇 드라마에서는 교통사고로 의식을 잃고 장기간 입원 중인 인물이 등장하곤 한다. 식물인간은 심각한 뇌 손상으로 의식과 운동 기능을 상실했으나 호흡이나 소화 등 생명을 유지하기 위한 다른 활동은 계속하는 이를 말한다. 현실에서는 교통사고 외에도 넘어져 머리를 부딪치거나 고의적인 충격으로 두부를 다치는 경우, 수술 중 뇌의 혈류가 막혀 의식을 잃는 등 ...
-
- [과학향기 Story] 계단 오르고 장애물 넘는다?… 자유자재로 변하는 모핑 휠 등장
- 기원전 3500년경 메소포타미아서부터 현재 전 세계에 이르기까지, 무려 5,500여 년간 인류 문명과 떼려야 뗄 수 없는 위대한 발명품이 있다. 회전축과 원형 틀이라는 간단한 구조로 이뤄진 ‘바퀴’다. 바퀴가 등장한 이후, 인류는 장거리 이동과 대량 운송에 큰 이점을 가질 수 있게 됐다. 사진 1. 바퀴는 인류의 역사와 함께 진화하며, 장거리...
이 주제의 다른 글
- [과학향기 for Kids] 다리로 걷고 ‘맛집’까지 찾는 물고기가 있다?
- [과학향기 for Kids] 지구 밖에도 생명체가 있을까? 유로파 탐사선 출발!
- [과학향기 for Kids] 왜 양치를 꼼꼼히 해야 할까?
- [과학향기 Story] 서로의 이름을 부르는 원숭이가 있다?
- [과학향기 for Kids] 가을에는 왜 나뭇잎이 알록달록 물들까?
- [과학향기 Story] 식물인간 넷 중 하나는 당신 말을 듣고 있다
- [과학향기 for Kids] 동물들은 가족의 죽음을 어떻게 받아들일까?
- [과학향기 Story] 에이즈, 더 이상 두려워할 필요 없다?
- [과학향기 for Kids] 멸종된 매머드, 다시 살아날 수 있을까?
- [과학향기 for Kids] 종이에 베이면 왜 이렇게 아플까?
ScienceON 관련논문



